Onco.UroWeb.ru - Онкоурология
Onco.UroWeb.ru - Онкоурология
|
|
Библиотека >> СтатьиРоль воспаления в развитии рака простаты или есть ли связь между простатитом и раком простатыПо материалам Journal Urology (Vol. 172, S6-S12, Ноябрь 2004) Американская урологическая ассоциация WILLIAM G. NELSON, ANGELO M. DE MARZO, THEODORE L. DeWEESE и WILLIAM B. ISAACS
Молекулярные аспекты развития рака простаты (информация для профессионалов)Главные факторы молекулярного патогенеза рака простаты, указывающие на роль простатита в канцерогенезе, - это 1) соматическая инактивация гена GSTP1, кодирующего глутатион-S-трансферазу (GST) пи-класса и 2) высокая вероятность того, что очаги пролиферативной воспалительной атрофии (PIA) предшествуют раковой опухоли [13,63,64]. Ферменты GST, катализирующие соединение защитного вещества глутатиона с различными веществами, в том числе окислителями, давно известны своей способностью предотвращать развитие рака. Прекращение транскрипции GSTP1 в результате избыточного метилирования участка CpG в соматических клетках почти всегда сопутствует раку простаты, хотя механизм избирательного метилирования de novo участка CpG на данный момент не выяснен [63]. В норме GSTP1 экспрессируется в базальном эпителии простаты и не экспрессируется в столбчатых секреторных клетках. Однако, экспрессия GSTP1 обычно значительно повышается в очагах воспаления простаты и снижается в очагах PIN и клетках рака простаты [63,64]. В результате потери функции GSTP1 снижается устойчивость к химическим канцерогенам. К примеру, в клетках рака простаты линии LNCaP, не экспрессирующих GSTP1, метаболически активированный PhIP (канцероген пережаренного мяса) вызывал более выраженные повреждения генома, чем в клетках LNCaP с восстановленной генетическими методами экспрессией GSTP1 [65]. В предварительном исследовании клетки LNCaP, генетически модифицированные для экспрессии GSTP1, накапливали больше мутаций при длительном воздействии окислителей. (DeWeese, T.L. и Nelson, W.G., неопубликованные данные). И, наконец, у мышей с поврежденными генами GSTP1/2 чаще развивались опухоли кожи при местном воздействии канцерогена 7,12-диметилбенз[a]антрацена [66].
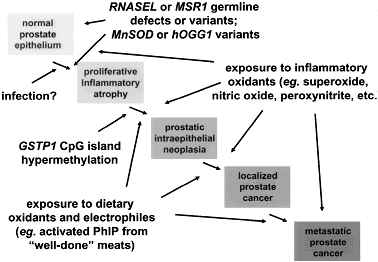
Рис. из J Urol Vol.172, S6-S12, November 2004: Под термином "пролиферативная воспалительная атрофия" - PIA - понимают очаги в простате, для которых характерна атрофия с пролиферацией эпителия и расположение рядом с активированными клетками воспаления [64]. Клетки PIA часто проявляют признаки стресса, такие как повышенная экспрессия GSTP1, GSTA1 и COX-2, а также черты промежуточной дифференцировки между базальным и столбчатым эпителием [28,64,67,68]. Появляется все больше доказательств того, что очаги PIA могут предшествовать раковой опухоли. Очаги PIA часто располагаются в непосредственной близости от очагов PIN и очагов рака простаты [64,69]. Мутации TP53, наблюдаемые приблизительно в 20% случаев рака простаты, обнаружены в 5.3% очагов PIA [70,71]. Увеличение числа повторов ДНК у центромеры восьмой хромосомы, встречающееся в около 6% случаев рака простаты, встречается в 4% очагов PIA [72]. И, наконец, участок избыточного метилирования CpG гена GSTP1, присутствующий более чем в 90% случаев при раке простаты, обнаруживается в 6.3% очагов PIA [73]. Тенденция к утрате функции GSTP1 при переходе от PIA к PIN (при PIN участок избыточного метилирования CpG гена GSTP1 встречается в 70%) согласуется с тем, что нарушение защиты от "кислородного взрыва" может провоцировать канцерогенез в простате [13]. Подтверждает эту гипотезу и известный факт, что рак желудка, провоцируемый хронической инфекцией Helicobacter pylori, также связан с хроническим воспалением, воспалительным повреждением эпителия и последующей атрофией эпителия (часто с кишечной метаплазией) и дисплазией [74, 75]. При таком хроническом воспалении эпителий многократно повреждается и восстанавливается на фоне действия свободных радикалов, выделяемых воспалительными клетками, и это повышает склонность к новообразованиям [74]. Перевод:
|